COVID-19(俗稱武漢肺炎)疫情在各國擴散,不只眾人關心的疫苗、特效藥之外,「檢測」也是在戰疫中的重要一環。檢驗到底怎麼做?如何擴充檢疫能量?
對此好奇的我,在 2 月初詢問了在做 RNA 相關研究的同學:「你知道有哪個實驗室負責檢測,或培養新型冠狀病毒(SARS-CoV-2)的嗎?」回應裡傳來了一段長庚大學新興病毒感染研究中心主任施信如教授的受訪影片。施信如的實驗室是目前檢測新型冠狀病毒(SARS-CoV-2)的主要實驗室之一 ,於是我寄了封邀訪的 e-mail 給老師,在 2 月底的連假有了造訪施信如實驗室的機會,藉此探詢技術、現實和理念。
檢測怎麼做呢?先從標的蛋白開始說起
「我們發現,採檢由較有經驗的醫師經手,比較容易檢測陽性ㄟ」施信如笑著說。
每天中央疫情指揮中心都一定會提到的「病毒篩檢」到底是怎麼做的呢?讓我們先從在病毒篩檢檢測中不可或缺的「標的蛋白」開始說起。
這次疫情的病原新型冠狀病毒(SARS-CoV-2),和 17 年前 SARS 病原 SARS-CoV、2015 年 MERS(Middle East Respiratory Syndrome Coronavirus Infections;中東呼吸症候群冠狀病毒感染症) 的病毒相當接近,在區分上有一定的難度。
那麼檢驗團隊是選用哪些引子(primer)來鑑定、確認新型冠狀病毒(SARS-CoV-2)呢?
施信如表示,實驗室採用的是 世界衛生組織(WHO, World Health Organization)於2020/01/13發表的建議,其中列出三種冠狀病毒的特有基因:RdRP gene、E gene,以及N gene[詳情如附件表格及資料補充],依 WHO 的建議步驟 ( protocol ) 處理樣本後上機,再依據 Ct 值判定樣本中的病毒 RNA 是否為陽性。
- Ct值指的是:樣本中的RNA在 PCR 複製達到醫檢師和儀器都認同的陽性所需要的次數,Ct 值越高代表病毒 RNA 濃度越低、患者體內病毒越少。
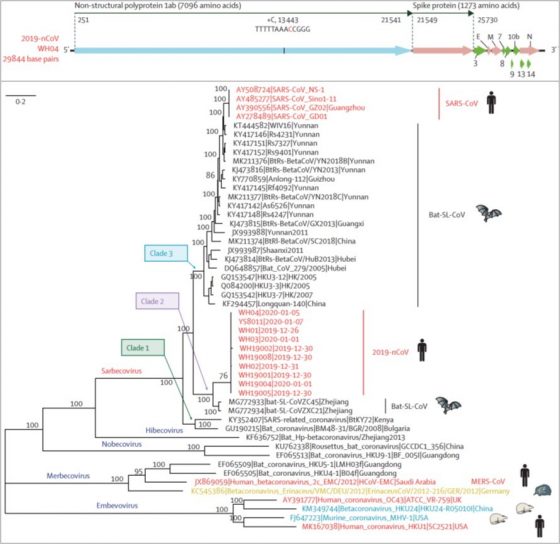
新型冠狀病毒和 17 年前的 SARS-CoV 病毒與其他相關的冠狀病毒的演化樹親戚推測圖。From: 參考文獻 1
儘管新型冠狀病毒(SARS-CoV-2)是 17 年前 SARS 病毒親戚,且雖然 RdRP gene 的 RT-PCR 結果也可以跑出陽性的 Ct 值,但細看 RdRP gene 序列,可發現有明顯的差異。而 N 和 E gene 的差異比 RdRP gene 更大,因此現用的 RT-PCR 的專一性 ( specificity )可以有效區分新型冠狀病毒(SARS-CoV-2)和它們的親戚們。
由於冠狀病毒不容易用培養的方式分離,因此現在的檢驗方式以反轉錄聚合酶鏈式反應(RT-PCR, reverse transcription Polymerase Chain Reaction)檢驗為主,簡單來說是在體外短時間的大量增加特定的基因片段做檢測,以此就可以用少量的檢體來做病毒檢測。
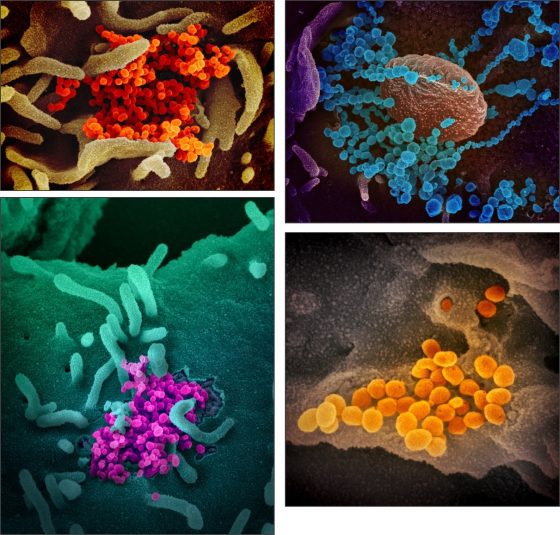
新型冠狀病毒(SARS-CoV-2)掃描式電子顯微鏡(數位上色)照片。From: Rocky Mountain Laboratories of National Institute of Allergy and Infectious Diseases
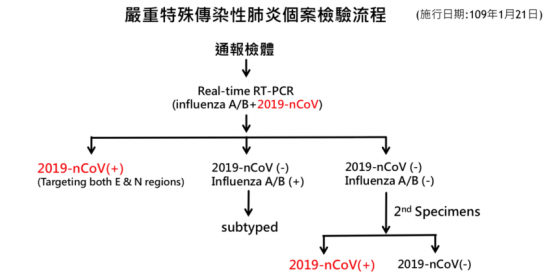
現階段對於新型冠狀病毒的疑似案例,或者病患的康復狀況,採樣與檢驗的流程簡要流程大約如下:
- Step 1:由醫護團隊採樣,樣本可能是痰液、咽喉拭子、血清等,後送至專門的檢驗室。
- Step 2:以選定的三個新型冠狀病毒(SARS-CoV-2)蛋白質的 RNA 與正控制組的人體內原有特定蛋白質 RNA,進行 RT-PCR 檢測。
- Step 3:根據檢測結果的 Ct(threshold cycle)值作出判定,結果可為陽性、陰性或無法判定。
施信如表示在農曆年前,台灣具備檢驗能力的實驗室僅八個;截至本採訪時,為了本次激增的檢驗需求,於 2 月底時全台已擴大至二十多個合格實驗室、一天最大容納量約兩千個樣本(註:3/14 已達每日約 3 千個樣本)。
當然,如此得出的檢驗報告只是醫護評估的工具之一,無法代表病人的情況。
目前實驗室的醫檢師檢驗量能是全滿的狀態註1,每日約可處理兩百個樣本,一次耗時約 4 小時。有時樣本中的病毒 RNA 量 Ct 值會很接近儀器的偵測下限,此時就要考慮請醫護團隊再行採檢,以避免採樣時所造成的誤差。
不同的樣本也會顯著影響 RNA 量,例如,咽喉拭子的 RNA 量會很高,但痰維持 RNA 陽性的時間則較久。 因此在康復的過程中,咽喉拭子的 RNA 可能會先無法被儀器測出,但痰液中的 RNA 仍可被儀器測得。
不過這些情況仍受很多變數影響,如醫護的採樣熟練度。
不是有驗就好:影響到檢測準確性的那些原因
「病毒長在細胞裡,如果只是輕輕抹一下,那喉頭拭子就檢測不到啊。」施信如說著。
當問到為什麼有時陰性、有時陽性,啊還有弱陽性的情況發生呢?「因為採檢的樣本裡病毒不夠或沒有啊。」施信如明快地回應。醫護對病人採樣,不僅來源多樣(如:痰液、咽喉拭子等),更有多項變因影響樣本裡的病毒量,下述僅列其中數項:
- 樣本來源:隨患者疾病發展階段(康復中,或惡化中),病毒在氣管內、咽喉部的量可能不同。註3。不同時期深咳而出的痰、咽喉拭子裡的病毒量可能都會變動。
- 採樣技術:病毒藏在細胞裡,醫護採樣時的細胞量若不夠,則病毒量可能低於儀器檢測下限。
- 康復情況:隨著醫護的照料,患者體內的病毒逐漸減少,所能採得的病毒 RNA 量自然更少,越接近完全康復、樣本裡的病毒量越可能少於檢測下限。
- 儀器極限:同上,理論可以無限,但機器有測定下限。
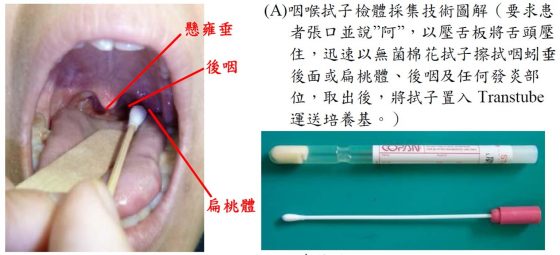
採集咽喉部位的檢體方式與說明。From:參考文獻 8
補充資料:檢測存在的不確定性
除了施信如所提之上述四種可能註4,世界衛生組織(WHO, World Health Organization)和美國疾病與預防中心(US CDC, Centers for Disease Control and Prevention)對於 RT-PCR 都有提出檢驗病毒時的建議步驟 7,9,10。
在其說明中,明確地指出檢測可能存在不確定性,而不是非黑即白,工作現場總是有科學難以掌握的灰色地帶。
美國疾病管制與預防中心針對各種可能的檢測結果說明 樣本第一次的重複 樣本第二次的重複 樣本第三次的重複 RP 檢驗結果 + + + ± 確診 若三次重複中,僅有1或2次重複呈現陽性 ± 不確定的檢驗結果 – – – + 不存在新型冠狀病毒 – – – – 無效的檢驗結果 From:參考文獻 9。
除了檢測,還有什麼計畫呢?
當詢問到最近實驗室針對病毒的研究有哪些進一步的規畫。施信如表示近期正試圖釐清病毒量和傳染力的關聯性。簡單來說,理論上一株病毒可以感染一顆細胞;但由於複製的缺陷、偶發的突變,病毒不見得每次都能複製出具有感染力的子代。
為了要釐清新型冠狀病毒(SARS-CoV-2)的感染力,利用 CT-PCR 定量病毒 RNA 的濃度,並結合 in vitro 的細胞實驗、觀察複製多代後的病毒對細胞的殺傷力,就能簡單地判斷此新病毒的感染力和複製能力。
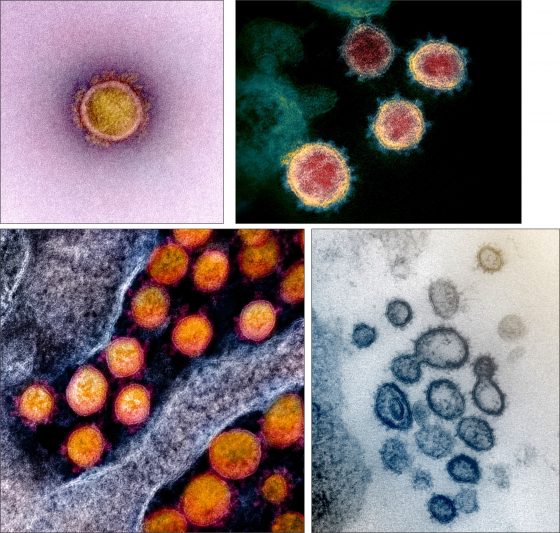
新型冠狀病毒(SARS-CoV-2)穿透式電子顯微鏡(部分使用數位上色)照片。From: Rocky Mountain Laboratories of National Institute of Allergy and Infectious Diseases
相關處理步驟如下,若對此有興趣的話不妨可以看看實驗是怎麼做:
- 第1步:複製特定基因的RNA (為避免從實驗室誤傳、外洩的危險,第1步先不以整個基因組或完整的病毒),量測各種RNA濃度和Ct值,獲得RNA濃度和Ct值之間的關係。
- 第2步:在受控制的條件下,培養真實的病毒。由於無法一顆顆地計算病毒顆粒數量,因此用RNA濃度代表病毒量。在實驗室裡培養各種濃度的病毒 (各種RNA濃度),準備進入第3步。
- 第3步:利用各種濃度的病毒,實際感染培養皿裡的細胞,利用計算溶菌斑(viral plaque)的方式,得到各種濃度的病毒感染細胞的能力。
- 重複1-3步,可以透過Ct值得到病毒量 (RNA濃度)和in vitro條件下的感染力,進而跟其他資料比較,推測新型冠狀病毒 (SARS-CoV-2)的各種特性。(以下為作者透過理解採訪,假設的推論,非施信如口述) 舉例而言,假設重複1-3步,在相同的病毒量 (RNA濃度)下,本次疫情的病毒,和 2002 年 SARS-CoV、2015年MERS,在in vitro條件下,發現不同的溶斑數量:
相同濃度的病毒 (RNA) SARS-CoV-2 SARS-CoV MERS 溶斑數量 100 70 20
- 此為假設結果,非實際實驗
因此可以知道相同的病毒濃度、 in vitro 條件裡,SARS-CoV-2 的感染力最高,因此可以猜測可能是:
- SARS-CoV-2 病毒的複製效率最好,每次複製後,獲得的活病毒比例最高
- SARS-CoV-2 病毒對細胞的結合能力最強,相同的時間裡,病毒能吸附、進入細胞的數量最多
- SARS-CoV-2 病毒對細胞的破壞速度最快,相同的時間裡,病毒能破壞的細胞數量最多
再透過猜測,發展其他的實驗模型去證明猜測的正確性。

溶菌斑(viral plaque)註5。此圖使用 Huh 7 cell line/人類肝癌細胞株,並用冠狀病毒系列的coronavirus 229E 感染,之後再用結晶紫(crystal violet)將活細胞染成紫色。圖中任一個非紫色的圓形,理論上可被視為被一顆病毒感染、破壞後的痕跡。圖中可見 4 個 wells 幾乎沒有細胞,病毒以將該 well 的細胞幾近都殺死。From:長庚新興病毒感染研究中心黃聖愉博士
藥物可能開發的方向?
目前新型冠狀病毒(SARS-CoV-2)現在主要是培養在非洲綠猴腎細胞 ( Vero E6 cells )中,但它在表皮細胞株系列也都長的不錯。而培養病毒成功後,除了觀察細胞病變外,另也可抽取培養上清液測 RNA;除此之外,市售的anti-SARS 抗體也能認出新型冠狀病毒,因此也可以透過螢光抗體、螢光顯微鏡的方式判斷病毒的增長量註6。
現在有許多團隊寄藥品到實驗室,希望能測試新藥對抗新型冠狀病毒的能力。部分藥物的目標是該病毒特殊的蛋白酶,也有部分研究團隊針對病毒在合成自身 RNA 的過程中,會偷用宿主的蛋白質,希望開發新藥物來阻斷這個「偷用宿主的 XXX」的步驟。
成功不必在我,扎實做實驗
施信如表示,研究前的計畫撰寫非常重要,雖然新型冠狀病毒是現下全球關注的焦點,但也不宜跟風地做研究、寫計畫。
科學是長久的領域,科學家應有著「成功不必在我」的心情來寫計畫、扎扎實實做實驗。「要鼓勵年輕人踏入科學、提出計畫、和全球最傑出的科學家合作。」施信如這麼說,儘管現處在疫情當下,但年輕的科學家仍應提出實在、可讓自己成長的計畫。與全球傑出的科學家們共同討論,讓他們批判、優化你的計畫,然後慢慢地成為一代大師。而且也要帶著比你更年輕的科學家一起寫,科學才能代代相傳、後繼有人。
保持冷靜,繼續前進。Keep Calm and Carry On.
註解
- 作者補充資料:有資格上機操作者是醫事檢驗師,並非醫師、藥師等
- 除Gisaid,病毒學家也常將基因組上傳到VIPR virus pathogen resource和NCBI。有了共同的知識庫,科學家們就可以互相研究彼此的發現、加速發展
- 由美國第一例被治癒的患者報告中,可發現糞便也曾在病程中某一日出現過病毒的RNA
- 施信如的說明,一定程度上解釋了為何韓國臨床文獻裡的結果卻飄忽不定的可能理由
- Viral Plaque, 溶菌斑。理論上,一顆病毒在破壞細胞後,會出現一個形狀近似正圓、無細胞的區域。可用此方式推理出病毒的濃度與其他特徵
- 作者補充:在尚無專一性極高的快篩商用套件的當下,可以利用市售的 anti-SARS 抗體進行研究、組件,甚至商業化
補充資料
補充資料1:RdRP、E gene 和 N gene
- RdRP,即 RNA-dependent RNA polymerase,可將病毒 RNA 複製成另一顆病毒的 RNA,是正鏈 RNA 病毒的必備酵素。由於通常不會出現在成熟的病毒顆粒中,屬非結構性蛋白(nonstructural protein)。通常人體沒有此類功能的酵素,因此也成為藥廠克制病毒的目標之一。
- N protein,負責保護、包裹病毒的 RNA 3
- 包膜蛋白 ( envelope (E) protein ),穿膜蛋白,與病毒生命週期的多方面有關,如裝配,出芽,包膜形成和發病機制 4。
可配合下面兩張新型冠狀病毒的外觀圖、剖面圖觀察。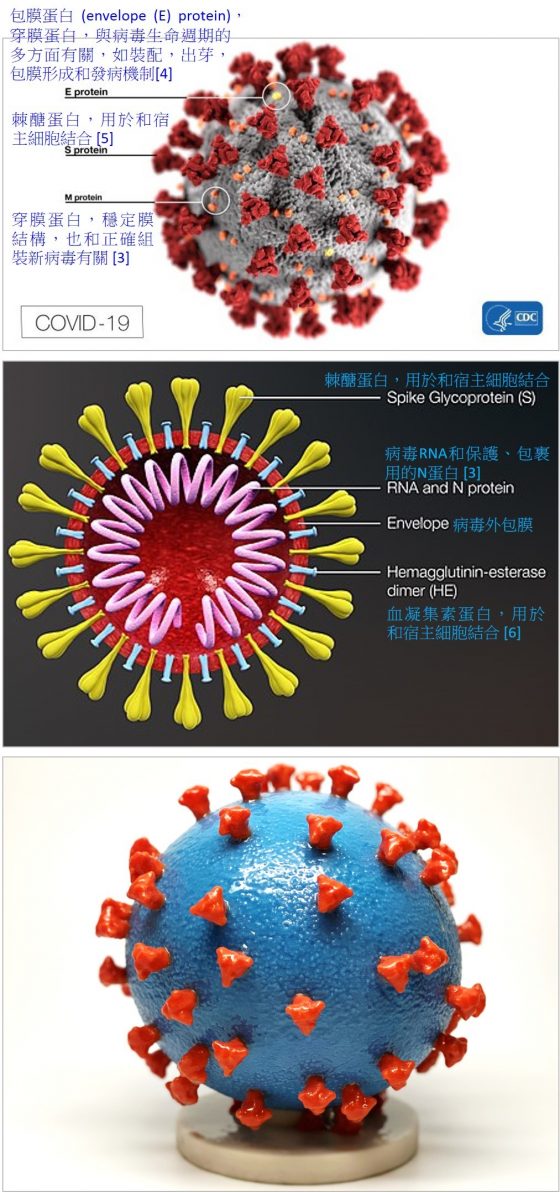
上圖:病毒外表示意圖。中圖:病毒剖面示意圖。下圖:新型冠狀病毒 3D 模型,我只是覺得可愛,沒有要解釋什麼~From:上:Scientific Animation。中:US CDC。下:Rocky Mountain Laboratories of National Institute of Allergy and Infectious Diseases。中文資訊為作者加註
| Assay/Use | Oligonucleotide ID | Sequence (5′-3′) | Comment |
| RdRP gene | RdRP_SARST-F2 | GTGARATGGTCATGTGTGGCGG | use 600 nM per reaction |
| RdRP_SARS-R1 | CARATGTTAAASACACTATTAGCATA | use 800 nM per reaction | |
| RdRP SARSr-P2 | FAM-CAGGTGGAACCTCATCAGGAGATGCBBQ | Specific for Wuhan-CoV, will not detect SARSCOV use 100 nM per reaction and mix with P1 |
|
| RdRP_SARSr-P1 | FAMCCAGGTGGWACRTCATCMGGTGATGCBBQ | Pan Sarbeco-Probe, will detect Wuhan virus, SARS-CoV and bat-SARS-related Cols use 100 nM per reaction and mix with P2 |
|
| E gene | E_Sarbeco_F1 | ACAGGTACGTTAATAGTTAATAGCGT | use 400 nM per reaction |
| E_Sarbeco_R2 | ATATTGCAGCAGTACGCACACA | use 400 nM per reaction | |
| E_Sarbeco_P1 | FAM-ACACTAGCCATCCTTACTGCGCTTCGBBQ | use 200 nM per reaction | |
| N gene | N_Sarbeco_F1 | CACATTGGCACCCGCAATC | use 600 nM per reaction |
| N Sarbeco R1 | GAGGAACGAGAAGAGGCTTG | use 800 nM per reaction | |
| N Sarbeco P1 | FAM-ACTTCCTCAAGGAACAACATTGCCABBQ | use 200 nM per reaction |
- Diagnostic detection of 2019-nCoV by real-time RT-PCR. WHO. 2020/01/13版裡推薦鑑定SAES-CoV-2的 primers。From: 參考文獻2
補充資料2: WHO之研究限制與採樣建議
為保證檢驗引子偵測之專一性,已對其他的冠狀病毒進行過 RT-PCR 測試,確保依循 WHO 文件操作,僅能檢出新型冠狀病毒(SARS-CoV-2)。相關文件內容簡述如下7:
此檢驗方法,已透過檢測 human coronaviruses (HCoV)-229E, -NL63, -OC43, -HKU1 and MERS-CoV(in vitro)。而無法用普通細胞培養的 HCoV-HKU1,亦利用人類上呼吸道培養病毒,以確保本文件推薦之方式不會測出上述冠狀病毒。
因此患者樣本裡若有足夠的本疫情之新型冠狀病毒(SARS-CoV-2)RNA 量,將可被本檢測方式檢出。
參考文獻
- Roujian Lu, Xiang Zhao, Juan Li, Peihua Niu, Bo Yang, Honglong Wu, Wenling Wang, Hao Song, Baoying Huang, Na Zhu, Yuhai Bi, Xuejun Ma, Faxian Zhan, Liang Wang, Tao Hu, Hong Zhou, Zhenhong Hu, Weimin Zhou, Li Zhao, Jing Chen, Yao Meng, Ji Wang, Yang Lin, Jianying Yuan, Zhihao Xie, Jinmin Ma, William J Liu, Dayan Wang, Wenbo Xu, Edward C Holmes, George F Gao, Guizhen Wu, Weijun Chen, Weifeng Shi, Wenjie Tan (2020) Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding. The Lancet. DOI: https://doi.org/10.1016/S0140-6736(20)30251-8
- Diagnostic detection of 2019-nCoV by real-time RT-PCR. WHO. 2020/01/13
- Benjamin W. Neuman, Gabriella Kiss, Andreas H. Kunding, David Bhella, M. Fazil Baksh, Stephen Connelly, Ben Droese, Joseph P. Klaus, Shinji Makino, Stanley G. Sawicki, Stuart G. Siddell, Dimitrios G. Stamou, Ian A. Wilson, Peter Kuhn, and Michael J. Buchmeier. (2015) A structural analysis of M protein in coronavirus assembly and morphology. Journal of Structural Biology. DOI: 10.1016/j.jsb.2010.11.021
- Dewald Schoeman & Burtram C. Fielding (2019) Coronavirus envelope protein: current knowledge. Virology Journal. 16. DOI: https://doi.org/10.1186/s12985-019-1182-0
- M. Alejandra Tortorici, Alexandra C. Walls, Yifei Lang, Chunyan Wang, Zeshi Li, Danielle Koerhuis, Geert-Jan Boons, Berend-Jan Bosch, Félix A. Rey, Raoul J. de Groot, and David Veesler. (2019) Structural basis for human coronavirus attachment to sialic acid receptors. Nature Structural & Molecular Biology. DOI: 10.1038/s41594-019-0233-y
- Qinghong Zeng, Martijn A. Langereis, Arno L. W. van Vliet, Eric G. Huizinga, and Raoul J. de Groot. (2008) Structure of coronavirus hemagglutinin-esterase offers insight into corona and influenza virus evolution. Proceedings of the National Academy of Sciences. DOI: 10.1073/pnas.0800502105
- Diagnostic detection of 2019-nCoV by real-time RT-PCR. WHO. 2020/01/17
- 2015 年季節性流感防治工作手冊。疾病管制署
- Real-Time RT-PCR Panel for Detection 2019-Novel Coronavirus. US CDC. 2020/01/24
- 2019-Novel Coronavirus (2019-nCoV) Real-time rRT-PCR Panel Primers and Probes. US CDC. 2020/01/24
